Exemplos De Segunda Lei Da Termodinâmica, um conceito fundamental da física que governa a direção dos processos naturais, está presente em tudo o que nos cerca. Desde a xícara de café que esfria até a formação de galáxias, a Segunda Lei nos revela a natureza irreversível do universo, onde a entropia, uma medida da desordem, sempre tende a aumentar.
Através de exemplos práticos e situações do dia a dia, exploraremos como essa lei impacta a vida, a tecnologia e o próprio cosmos. Mergulhe conosco nesse universo de conhecimento e desvende os mistérios da Segunda Lei da Termodinâmica.
Introdução à Segunda Lei da Termodinâmica
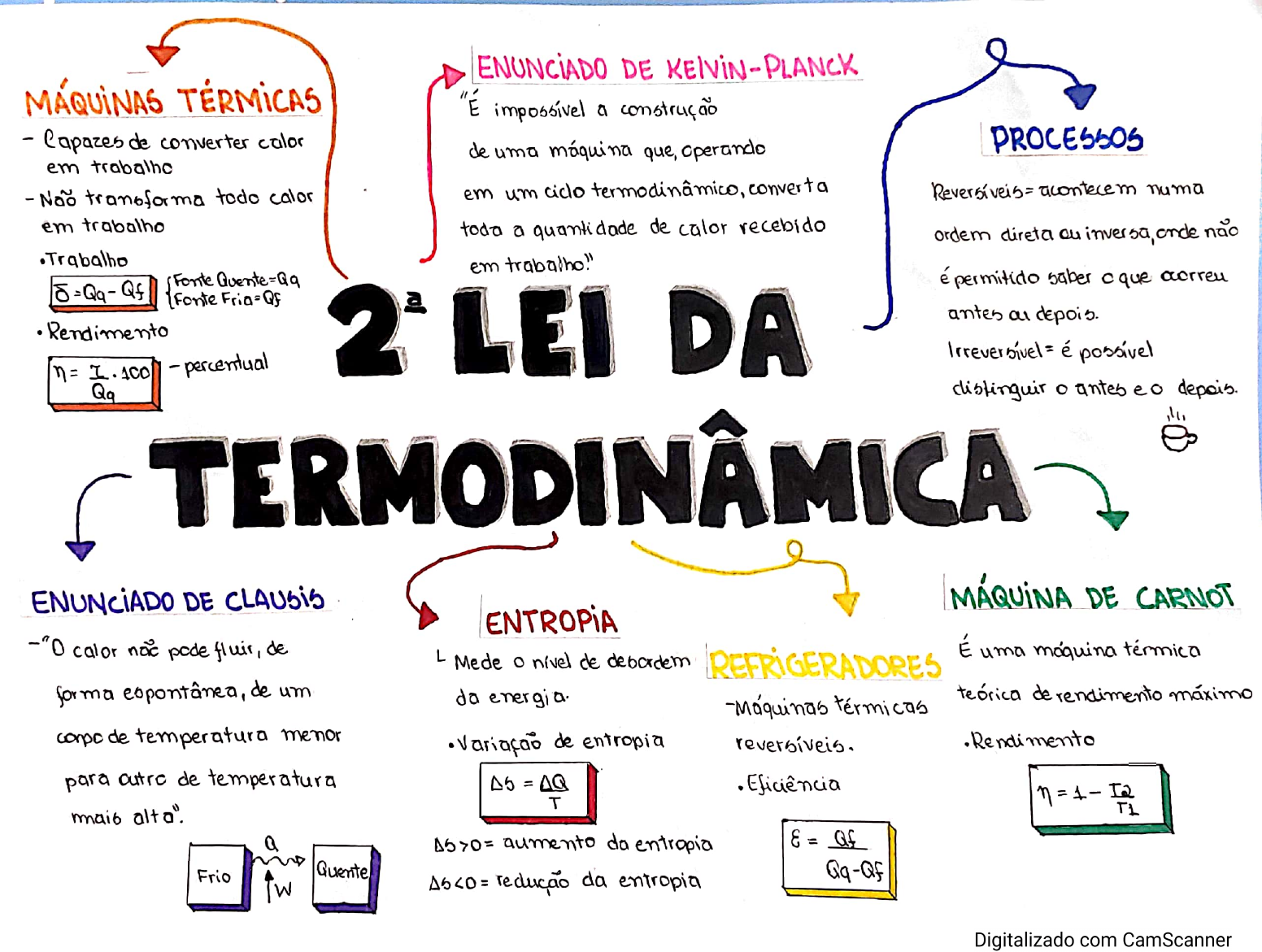
A Segunda Lei da Termodinâmica é um dos princípios fundamentais da física que descreve o comportamento da energia e como ela se transforma. Em termos simples, a Segunda Lei afirma que a energia sempre flui de um objeto mais quente para um objeto mais frio, e que os processos naturais tendem a aumentar a entropia, ou seja, a desordem de um sistema.
A entropia é uma medida da desordem ou aleatoriedade de um sistema. A Segunda Lei da Termodinâmica estabelece que a entropia de um sistema isolado sempre aumenta com o tempo. Isso significa que os processos naturais tendem a mover-se em direção a um estado de maior desordem, e que é impossível criar um processo que diminua a entropia sem adicionar energia ao sistema.
Os processos que aumentam a entropia são considerados irreversíveis, pois não podem ser revertidos espontaneamente.
Exemplos do dia a dia que ilustram a Segunda Lei da Termodinâmica incluem o derretimento de um cubo de gelo em um copo de água quente, a mistura de água quente e fria em um único recipiente, e o resfriamento de uma xícara de café quente.
Em todos esses casos, a energia flui do objeto mais quente para o mais frio, e a entropia do sistema aumenta.
Enunciados da Segunda Lei da Termodinâmica
A Segunda Lei da Termodinâmica pode ser expressa de várias maneiras, mas os enunciados mais comuns são os de Clausius e Kelvin-Planck.
- Enunciado de Clausius:É impossível construir um dispositivo que opere em um ciclo e cujo único efeito seja transferir calor de um corpo mais frio para um corpo mais quente.
- Enunciado de Kelvin-Planck:É impossível construir um dispositivo que opere em um ciclo e cujo único efeito seja converter calor completamente em trabalho.
Os dois enunciados são equivalentes, ou seja, se um deles é verdadeiro, o outro também é. Ambos os enunciados expressam a irreversibilidade dos processos termodinâmicos e a impossibilidade de criar uma máquina de movimento perpétuo de segunda espécie.
| Enunciado | Definição | Exemplo prático |
|---|---|---|
| Clausius | Impossibilidade de transferência de calor espontânea de um corpo frio para um corpo quente. | Uma geladeira precisa de energia para transferir calor do interior frio para o ambiente externo mais quente. |
| Kelvin-Planck | Impossibilidade de converter calor completamente em trabalho. | Uma usina termoelétrica não consegue converter todo o calor fornecido pelo combustível em energia elétrica. |
Aplicações da Segunda Lei da Termodinâmica
A Segunda Lei da Termodinâmica tem diversas aplicações importantes em diferentes áreas da ciência e tecnologia. Ela é fundamental para a análise de máquinas térmicas, como motores a vapor e turbinas, e para a compreensão da eficiência de conversão de energia térmica em trabalho.
A Segunda Lei limita a eficiência de conversão de energia térmica em trabalho, pois parte da energia sempre será dissipada como calor para o ambiente. Essa limitação é conhecida como o ciclo de Carnot, que define a eficiência máxima que uma máquina térmica pode atingir.
A Segunda Lei também é aplicada em diversos processos industriais e tecnológicos, como a produção de eletricidade em usinas termoelétricas, a refrigeração de alimentos, e a produção de materiais de alta pureza.
Exemplos Práticos da Segunda Lei da Termodinâmica
A Segunda Lei da Termodinâmica está presente em diversos fenômenos do dia a dia. Alguns exemplos incluem:
| Processo | Descrição | Variação de entropia | Tipo de irreversibilidade |
|---|---|---|---|
| Transferência de calor | Um objeto quente em contato com um objeto frio. | Aumenta | Irreversibilidade térmica |
| Diluição de um soluto | A adição de um soluto a um solvente. | Aumenta | Irreversibilidade de mistura |
| Mistura de gases | A mistura de dois gases diferentes. | Aumenta | Irreversibilidade de mistura |
| Expansão livre de um gás | Um gás se expande para um volume maior sem realizar trabalho. | Aumenta | Irreversibilidade de expansão livre |
Consequências da Segunda Lei da Termodinâmica
A Segunda Lei da Termodinâmica tem implicações profundas para a vida e o universo. Uma das consequências mais importantes é a morte térmica do universo, que prevê que o universo eventualmente atingirá um estado de equilíbrio térmico, onde a temperatura será uniforme e não haverá mais energia disponível para realizar trabalho.
A Segunda Lei também influencia a evolução da vida e a organização de sistemas complexos. A vida é um processo que exige a organização de matéria e energia, e a Segunda Lei implica que essa organização só é possível com a entrada constante de energia do ambiente.
A Segunda Lei da Termodinâmica tem implicações importantes para a sustentabilidade e a utilização de recursos naturais. A Segunda Lei nos alerta para a necessidade de utilizar os recursos naturais de forma eficiente e reduzir a produção de entropia.
Commonly Asked Questions: Exemplos De Segunda Lei Da Termodinâmica
Qual a diferença entre a Segunda Lei da Termodinâmica e a Primeira Lei?
A Primeira Lei da Termodinâmica trata da conservação de energia, enquanto a Segunda Lei define a direção dos processos termodinâmicos, estabelecendo que a entropia sempre aumenta em um sistema isolado.
Como a Segunda Lei da Termodinâmica se aplica à vida?
A vida, apesar de parecer desafiar a Segunda Lei, na verdade a utiliza para se manter organizada. Os organismos vivos consomem energia para manter sua ordem interna, mas liberam calor e entropia para o ambiente, garantindo o aumento da entropia total do universo.
A Segunda Lei da Termodinâmica implica que o universo está caminhando para a morte térmica?
A morte térmica do universo é uma hipótese que sugere que, com o passar do tempo, a entropia do universo irá aumentar até atingir um estado de equilíbrio térmico, onde não haverá mais energia disponível para realizar trabalho. No entanto, a complexidade do universo e a existência de fenômenos como a expansão acelerada ainda geram debates sobre essa hipótese.

