Introdução às Funções Orgânicas

Cite As Funções Orgânicas E Dê Exemplo De Cada – A química orgânica estuda os compostos de carbono e suas propriedades. Uma das bases do estudo da química orgânica é a compreensão das funções orgânicas, grupos de átomos que conferem características químicas específicas às moléculas. O estudo destas funções permite prever o comportamento químico das substâncias e suas aplicações.
As funções orgânicas são categorizadas com base em grupos funcionais, átomos ou grupos de átomos que determinam as propriedades químicas de uma molécula orgânica. A identificação da função orgânica presente em uma molécula é crucial para entender sua reatividade e comportamento.
Tabela das Seis Principais Funções Orgânicas
| Função Orgânica | Fórmula Geral | Exemplo | Aplicações |
|---|---|---|---|
| Álcoois | R-OH | Etanol (CH3CH2OH) | Bebidas alcoólicas, combustível, desinfetante |
| Aldeídos | R-CHO | Formaldeído (HCHO) | Produção de resinas, desinfetante |
| Cetonas | R-CO-R’ | Acetona (CH3COCH3) | Solvente, removedor de esmalte |
| Ácidos Carboxílicos | R-COOH | Ácido acético (CH3COOH) | Vinagre, produção de polímeros |
| Ésteres | R-COO-R’ | Acetato de etila (CH3COOCH2CH3) | Solventes, essências artificiais |
| Aminas | R-NH2 | Metilamina (CH3NH2) | Produção de medicamentos, fertilizantes |
Álcoois: 6 Cite As Funções Orgânicas E Dê Exemplo De Cada
Os álcoois são caracterizados pela presença do grupo hidroxila (-OH) ligado a um átomo de carbono saturado. Suas propriedades físicas e químicas variam de acordo com o tamanho da cadeia carbônica e a posição do grupo hidroxila.
Propriedades Físicas e Químicas dos Álcoois
Os álcoois apresentam pontos de ebulição mais elevados que os hidrocarbonetos de massa molar semelhante devido às ligações de hidrogênio entre as moléculas. São geralmente solúveis em água, com a solubilidade diminuindo com o aumento do tamanho da cadeia carbônica. Os álcoois podem sofrer reações de oxidação, desidratação e esterificação.
Exemplos de Álcoois e suas Aplicações
O etanol é utilizado como combustível, solvente e na produção de bebidas alcoólicas. O metanol é um solvente industrial tóxico. O glicerol é um componente do sabão e de cosméticos.
Álcoois Primários, Secundários e Terciários
A classificação dos álcoois em primários, secundários e terciários baseia-se no número de grupos alquila ligados ao átomo de carbono que carrega o grupo hidroxila. Álcoois primários são mais facilmente oxidados do que secundários, que por sua vez são mais facilmente oxidados que terciários. Álcoois terciários não sofrem oxidação fácil.
Aldeídos e Cetonas
Aldeídos e cetonas são compostos carbonílicos, contendo o grupo carbonila (C=O). A diferença reside na posição do grupo carbonila na molécula.
Diferenças entre Aldeídos e Cetonas
Em aldeídos, o grupo carbonila está ligado a pelo menos um átomo de hidrogênio. Já nas cetonas, o grupo carbonila está ligado a dois átomos de carbono. Esta diferença estrutural influencia suas propriedades químicas, principalmente na reatividade à oxidação. Aldeídos são mais facilmente oxidados que cetonas.
Exemplos de Aldeídos e Cetonas e suas Aplicações
O formaldeído é usado na produção de resinas e como desinfetante. A acetona é um solvente comum em removedores de esmalte. A vanilina é um aldeído responsável pelo aroma da baunilha.
Reações Características de Aldeídos e Cetonas, 6 Cite As Funções Orgânicas E Dê Exemplo De Cada
Aldeídos e cetonas podem sofrer reações de adição nucleofílica ao grupo carbonila. Aldeídos sofrem oxidação facilmente, formando ácidos carboxílicos, enquanto cetonas resistem à oxidação sob condições brandas.
Ácidos Carboxílicos
Os ácidos carboxílicos são caracterizados pela presença do grupo carboxila (-COOH), que confere a eles propriedades ácidas.
Acidez dos Ácidos Carboxílicos
A acidez dos ácidos carboxílicos é devido à estabilização por ressonância do íon carboxilato formado após a perda de um próton. Eles são mais ácidos que álcoois e outros compostos orgânicos com hidrogênio ácido.
Exemplos de Ácidos Carboxílicos Importantes
O ácido acético é o principal componente do vinagre. O ácido cítrico é encontrado em frutas cítricas. O ácido benzóico é um conservante de alimentos.
Formação de Ésteres
Ésteres são formados a partir da reação de esterificação entre um ácido carboxílico e um álcool, na presença de um catalisador ácido. Esta reação é reversível.
Ésteres
Os ésteres são derivados de ácidos carboxílicos, caracterizados pela substituição do hidrogênio do grupo hidroxila por um grupo alquila ou arila.
Características e Propriedades dos Ésteres
Muitos ésteres possuem aromas agradáveis e são encontrados em frutas e flores. São geralmente pouco solúveis em água e possuem pontos de ebulição mais baixos que os ácidos carboxílicos correspondentes.
Exemplos de Ésteres e seus Usos
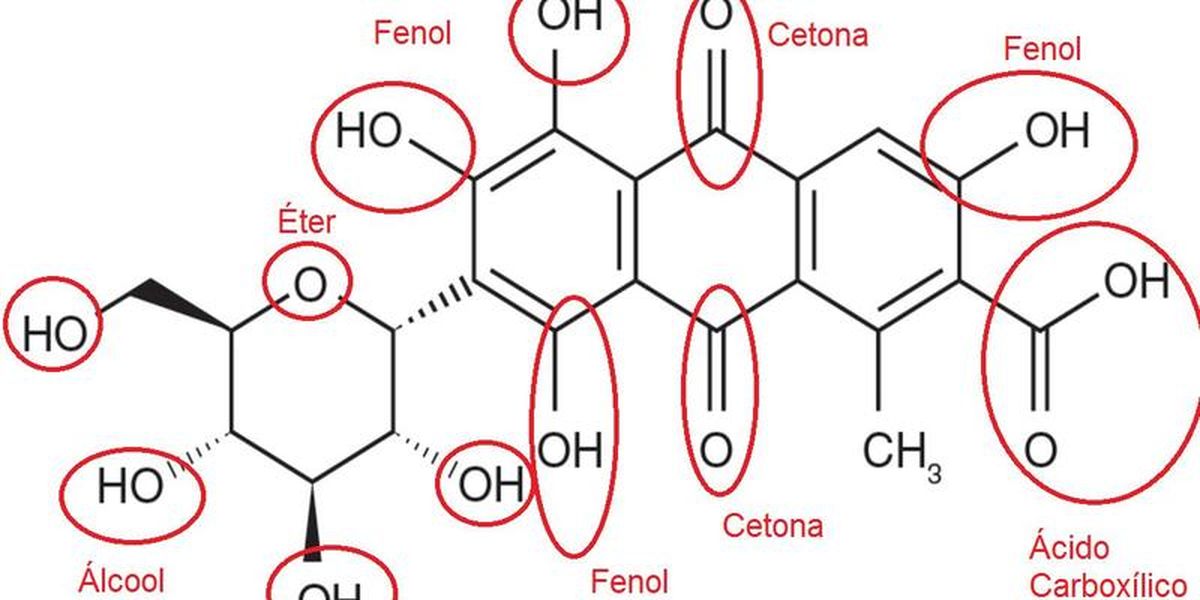
O acetato de etila é um solvente comum. Muitos ésteres são usados como essências artificiais em alimentos e perfumes.
Reação de Formação de Ésteres e Saponificação
A reação de formação de ésteres é uma reação de condensação, enquanto a saponificação é a reação de hidrólise básica de um éster, produzindo um sal de ácido carboxílico (sabão) e um álcool.
Aminas
As aminas são compostos orgânicos derivados da amônia (NH 3), onde um ou mais átomos de hidrogênio são substituídos por grupos alquila ou arila.
Propriedades Químicas e Físicas das Aminas
Aminas são bases fracas, capazes de aceitar um próton. Suas propriedades físicas dependem do tamanho e da estrutura da cadeia carbônica. Aminas de baixo peso molecular são geralmente solúveis em água.
Exemplos de Aminas e suas Aplicações
A anilina é usada na produção de corantes. Muitas aminas são componentes de medicamentos, como a efedrina e a adrenalina.
Classificação das Aminas
Aminas são classificadas como primária, secundária ou terciária, dependendo do número de grupos alquila ou arila ligados ao átomo de nitrogênio. Esta classificação afeta suas propriedades químicas e físicas.
Aplicações das Aminas na Indústria Farmacêutica
As aminas desempenham um papel crucial na síntese de uma vasta gama de fármacos. Sua capacidade de atuar como bases e formar sais com ácidos torna-as úteis na modificação de propriedades de medicamentos, melhorando sua solubilidade, absorção e estabilidade. Muitos medicamentos, incluindo analgésicos, antibióticos e anti-histamínicos, contêm estruturas aminas em sua composição.
Qual a diferença entre um álcool primário, secundário e terciário?
A diferença está no número de grupos carbonila ligados ao carbono que possui a hidroxila (-OH). Primário: 1 grupo; Secundário: 2 grupos; Terciário: 3 grupos. Isso afeta a reatividade, por exemplo, na oxidação.
Onde encontro mais informações sobre as reações de ésteres?
Livros didáticos de química orgânica, sites especializados e vídeos educativos online são ótimas fontes de informação. Procure por “reações de esterificação” e “saponificação”.
As aminas são sempre tóxicas?
Não, a toxicidade das aminas varia bastante dependendo da sua estrutura. Algumas são inofensivas, enquanto outras podem ser altamente tóxicas. A complexidade da molécula e sua interação com o organismo influenciam a toxicidade.

